Em misturas gasosas, a determinação do volume total depende dos volumes parciais dos gases componentes. Sendo que:
O volume parcial de um gás em uma mistura gasosa é o volume que ele irá ocupar estando sozinho e sendo submetido à pressão total e à temperatura da mistura.
É como se os gases não se misturassem. Assim, o volume que cada um ocuparia, estando no mesmo recipiente, seria seu volume parcial.
O conceito de volume parcial é análogo, portanto, ao da pressão parcial – e pode ser visto no texto “Pressão Parcial”. Assim como a pressão total de uma mistura gasosa é conseguida por meio da soma das pressões parciais dos gases; o volume total também é obtido pela somatória dos volumes parciais:

Essa relação é conhecida como Lei de Amagat dos volumes parciais.
Relacionando-a com a equação de estado dos gases:
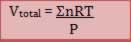
Pode-se também definir a fração molar (X) em função do volume parcial. Considere um gás “A” presente em uma mistura gasosa. Sua fração molar será dada por:
XA= nA = VA___ = % em volume de A
Σn Vtotal 100%
Para entender, pense, por exemplo, em um cilindro de combustível com 20 L de gás natural, sendo que seus principais constituintes são o metano, o etano e o propano. Como o metano corresponde a 85% do volume total do gás natural, ele possui 17 L. Já o etano é 10%, ou 2,0 L e o propano corresponde a apenas 5%, que é igual a 1,0 L. Se somarmos os volumes parciais, chegaremos exatamente ao valor do volume total:
V = Vmetano+ Vetano+ Vpropano
V = 17 L + 2 L + 1 L
V = 20 L
Se quiséssemos calcular o valor do volume parcial de cada gás, poderíamos usar a equação de estado dos gases ou a fração molar, como é mostrado abaixo no caso do metano:
Vmetano=85% . 20 L = 17 L
100%