A fim de medir as massas relativas dos átomos e das moléculas foi escolhido um padrão, que é “um pedaço de um átomo”. Em 1962, convencionou-se então que esse padrão seria a massa do isótopo do carbono 12 (12C). Esse átomo possui 6 prótons e 6 nêutrons e tem, por definição, a massa de 12,0 u exatamente. Assim, temos a seguinte relação:
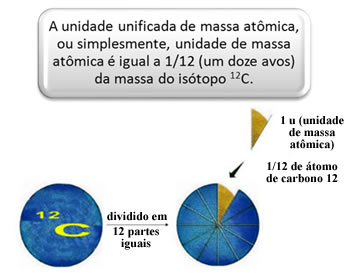
Por exemplo, temos que:
- Massa atômica de 1 átomo de hidrogênio: 1 u.
- Massa atômica de 1 átomo de oxigênio: 16 u.
- Massa atômica de 1 átomo de enxofre: 32 u.
- Massa atômica de 1 átomo de carbono: 12u.
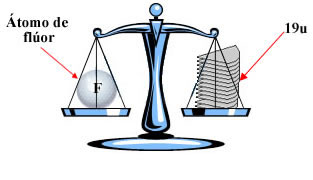
Para entender, pense numa balança imaginária, onde se coloca em um dos pratos um átomo de flúor. Para equilibrar os pratos, seria necessário colocar no prato vazio 19 u, como mostrado abaixo. Portanto, a massa atômica do flúor é 19 u.
1 u corresponde a 1,66054 . 10-24 g.
Esses valores são aproximados, pois na verdade o número de massa (A - que é a soma do número de prótons e de nêutrons que há no núcleo e que não tem unidade) não é a mesma coisa que a massa atômica, pois esta é determinada experimentalmente e constitui uma propriedade física do átomo, sendo sua unidade expressa por “u”.
Um equipamento chamado de espectrômetro de massas é utilizado para determinar com exatidão de seis casas decimais a massa de um isótopo. Veja alguns exemplos:
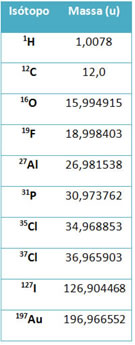
No entanto, no Ensino Médio, usam-se os valores aproximados, considerando que as massas atômicas correspondam ao seu respectivo número de massa.
Note que nos exemplos dados na tabela foi especificada a massa atômica de isótopos e não dos elementos. Isso foi feito porque os isótopos que compõem determinado elemento químico se diferenciam apenas pela quantidade de nêutrons existentes em seu núcleo. Por isso, seus números de massa e, consequentemente, suas massas atômicas são diferentes.
Portanto, para determinar a massa atômica para um elemento é necessário considerar a média ponderada de cada isótopo natural proporcionalmente à sua abundância.
Por exemplo, consideremos o elemento neônio (Ne), que possui três isótopos na natureza. Com o espectrômetro de massas é possível determinar que a massa atômica de cada um desses isótopos e suas porcentagens em massa, isto é, suas abundâncias relativas, são:
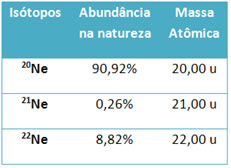
O cálculo para determinar a massa atômica desse elemento é dado pela média ponderada das massas atômicas desses isótopos:
Massa atômica do elemento neônio = (20,00 . 90,92) + (21,00 . 0,26) + (22,00 . 8,82)
100
Massa atômica do elemento neônio = 20,179
Aproveite para conferir nossas videoaulas relacionadas ao assunto: