A titulação é uma técnica experimental, muito usada em laboratórios químicos e em indústrias de pequeno porte, para determinar a concentração desconhecida de uma solução.
Para a realização dessa técnica, de modo simples, seguem os seguintes passos principais:
1. A solução que possui a concentração desconhecida é chamada de titulado. Primeiramente ela é medida com o auxílio de uma pipeta volumétrica, que nos dá o seu volume preciso e depois é transferida para um erlenmeyer;
2. Adiciona-se um indicador ácido-base (fenolftaleína, violeta de metila, azul-de-bromofenol, alaranjado de metila, azul-de-bromotimol, vermelho-de-fenol, vermelho-de-metila, etc). O indicador é muito importante nesse processo, pois, conforme será explicado mais adiante, ele indicará visualmente o ponto de viragem do pH da solução;
3. A solução de concentração conhecida é denominada titulante, o qual é colocado em uma bureta, normalmente de 50 mL. A bureta é um aparelho de vidro graduado, que permite o controle da quantidade de titulante que é adicionada ao titulado;
4. O passo seguinte é realizar o gotejamento da solução titulante sobre a solução titulada. Ao mesmo tempo, a solução presente no erlenmeyer deve ser constantemente agitada. É necessária também muita atenção, pois é preciso interromper o gotejamento exatamente quando a quantidade de íons H+ e OH-, em mol, da solução titulante, ficar igual à da solução titulada.
5. Ponto de equivalência ou ponto de viragem: é nesse momento em que a quantidade adicionada de titulante, em mol, é igual à determinada pela proporção estequiométrica para a reação com o titulado. É possível verificar esse ponto quando ocorre a mudança de cor da solução. Por exemplo, se for usado o indicador fenolftaleína, o seu ponto de viragem ocorre quando há a mudança do incolor para o rosa, ou vice-versa.
A escolha do indicador que será usado na titulação é muito importante, porque cada indicador tem um ponto de viragem em determinado pH – nem sempre sendo em pH igual a 7, que indica uma solução neutra. A própria fenolftaleína possui ponto de viragem em pH entre 8,3 a 10,0, isto é, em meio básico; assim, ela não pode ser usada, por exemplo, para titulações em que a viragem se dá em pH ácido.

6. Lemos na bureta o volume de titulante gasto e realizamos um cálculo para descobrir a concentração desconhecida, conforme é mostrado no exemplo a seguir:
“Digamos que a solução a ser titulada, com concentração desconhecida, seja o ácido clorídrico (HCl), e o titulante usado seja o hidróxido de sódio (NaOH) a 0,1 mol. L-1. Uma alíquota (amostra) de 25 mL de HCl é neutralizada totalmente quando titulada com 10 mL do hidróxido. Qual é a concentração inicial da solução de HCL?”
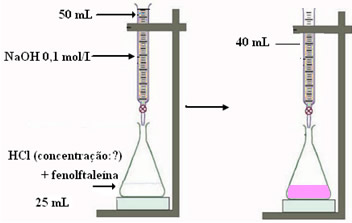
Resolução:
Sabemos quanto do titulante (NaOH) foi necessário para neutralizar o titulado. Porém, precisamos saber esse dado em quantidade de matéria (mol). Lembre-se que o volume deve ser dado em L, por isso, se foram gastos 10 mL, então é o mesmo que 10-2 L ou 10: 1000.
nNaOH = M . V
nNaOH = 0,1 mol. L-1. 10-2L
nNaOH = 10-3 mol
Agora precisamos representar a equação química da reação de neutralização que ocorreu, para vermos a proporção estequiométrica:
NaOH + HCl → NaCl + H2O
Proporção: 1mol 1 mol 1 mol
10-3mol 10-3mol 10-3mol
A proporção mostra que, para neutralizar 10-3 mol de NaOH, é preciso ter 10-3 mol de HCl, pois a proporção é de 1:1. Assim, temos todos os dados para jogar na fórmula da concentração molar e encontrar a concentração de HCl:
MHCl = _n_
V
MHCl = __10-3mol_
25 . 10-3 L
MHCl = 0,04 mol/L