As reações de oxirredução, como dito no texto “Oxidorredução” são reações nas quais ocorre simultaneamente perda e ganho de elétrons. O átomo ou íon que perde elétrons sofre uma oxidação e o que ganha sofre a redução.
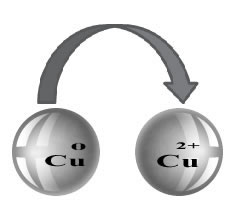
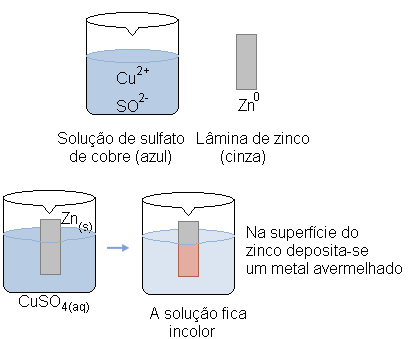
Por exemplo, se colocarmos uma placa de zinco em uma solução de sulfato de cobre, que contém cátions cobre II, o zinco irá oxidar, doando elétrons para o cobre, que irá reduzir:
Zn0(s) → Zn2+(aq) + 2 elétrons
Cu2+(aq) + 2 elétrons → Cu0(s)
Zn0(s)+ Cu2+(aq) → Zn2+(aq) + Cu0(s)
Nesse caso, temos dois metais, o cobre e o zinco, porém o zinco tem maior tendência de doar elétrons, por isso ele é que sofrerá a oxidação. Dizemos que ele é mais reativo que o cobre, pois temos a seguinte definição para a reatividade de um metal:

Isso significa que se quisermos realizar a reação contrária, conforme mostrada abaixo, na qual o cobre oxida, doando elétrons para zinco, isso não será possível em meios espontâneos:
Cu0(s)+ Zn2+(aq) → não ocorre reação espontânea
Essa reação só ocorrerá se fornecermos energia ao sistema, pois a transferência de elétrons de um átomo de metal menos reativo para o cátion de um metal mais reativo não é espontânea.
Comparando vários metais, os químicos conseguiram determinar quais têm maior tendência e menor tendência de ceder elétrons. Com isso surgiu a fila de reatividade ou fila das tensões eletrolíticas, que é dada a seguir:
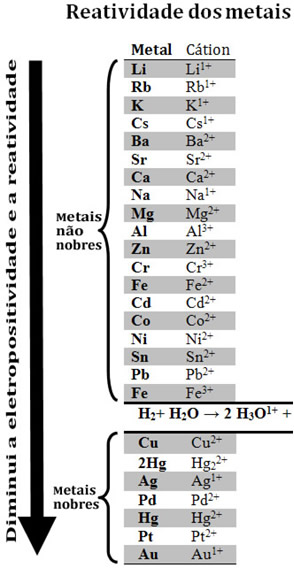
Veja que, apesar de não ser um metal, o hidrogênio aparece nessa fila de reatividade porque quando ele está presente em determinadas substâncias (como os ácidos) ele é capaz de formar o cátion hidrônio (H3O1+). Esse cátion pode receber elétrons formando gás hidrogênio e água, segundo a reação:
2 H3O1+(aq) + 2e-→ H2(g) + 2 H2O(l)
Os metais menos reativos que o hidrogênio são denominados metais nobres.
O metal mais reativo desloca o cátion do metal menos reativo. Observe novamente na fila de reatividade que o Zn aparece antes que o Cu, isto é, ele é mais reativo e, portanto, é ele quem desloca o cátion do cobre.
Assim, consultando essa fila de reatividade, pode-se prever se ocorrerá ou não determinada reação de oxirredução.
Veja, por exemplo, o experimento a seguir, no qual se colocou amostras de cobre (Cu), alumínio (Al) e zinco (Zn) em ácido clorídrico (HCl). Olhando para a fila de reatividade vemos que o Al e o Zn são mais reativos que o hidrogênio, portanto, essas reações vão ocorrer, sendo que, como o zinco é mais reativo, a sua oxidação se dará com maior rapidez que a do alumínio. Já o Cu é menos reativo que o hidrogênio (veja que na escala de reatividade ele aparece logo abaixo do hidrogênio). Isso significa que essa reação não ocorrerá, pois ele não deslocará o cátion do hidrogênio.

Veja também que o ouro (Au) é o menos reativo de todos os metais. Esse é um dos motivos de ele ser tão valioso, pois ele resiste ao ataque de ácidos isolados, sendo atacado somente por água régia, que é uma mistura de três partes de ácido clorídrico com uma parte de ácido nítrico.