Para facilitar o estudo da Química, as suas substâncias de estudo foram reunidas de modo a formar grupos em que os componentes tivessem características e propriedades semelhantes.
Assim, na metade do século XVIII, as substâncias químicas passaram a ser classificadas em inorgânicas ou orgânicas.
No passado, este termo “inorgânico” também chamado de “mineral” era utilizado para classificar aqueles compostos de origem mineral. Enquanto que os compostos orgânicos eram vindos de organismos vivos.
Entretanto, com o passar do tempo, o significado destes termos mudou, sendo que os compostos “orgânicos” passaram a ser aqueles que contêm o carbono em sua estrutura como principal elemento, enquanto que “inorgânico” passou a designar os compostos formados pelos demais elementos químicos.
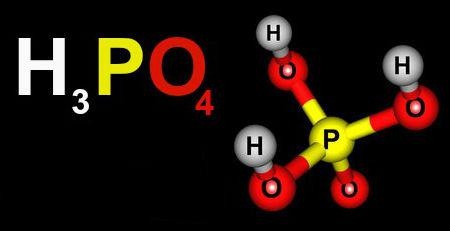
A Química Inorgânica possui quatro classes principais: ácidos, bases, sais e óxidos.