As propriedades coligativas são aquelas que dependem somente da quantidade de partículas presentes, isto é, da sua concentração, e não da natureza destas.
Tais fenômenos são vistos comumente em nosso dia a dia e são explicados pela interação que há entre as partículas.
Existem quatro propriedades coligativas. Vejamos cada uma delas:
1. Tonoscopia ou Tonometria: é o estudo da diminuição da pressão máxima de um solvente pela adição de um soluto não volátil.
Se compararmos a evaporação da água com a de uma solução de água e açúcar, veremos que a água pura evapora mais rapidamente, assim sua pressão de vapor será maior.
Isso ocorre porque, no caso da água, a evaporação se dá quando uma molécula localizada na superfície adquire energia cinética suficiente para romper as forças de atração com as outras moléculas (força intermolecular, nesse caso, é a ligação de hidrogênio) e se desprende para fora da massa líquida.
Entretanto, ao se adicionar um soluto não volátil, como o açúcar, aumentam-se as interações entre as moléculas das espécies químicas presentes, dificultando a evaporação.
2. Ebulioscopia ou Ebuliometria: é o estudo do aumento da temperatura de ebulição de um solvente pela adição de um soluto não volátil.
Esse efeito pode ser visto, por exemplo, quando estamos fazendo café e a água está para entrar em ebulição, mas, quando adicionamos o açúcar, ela para de ferver. Ou seja, o ponto de ebulição aumentou, então será necessário elevar mais ainda a temperatura, continuar esquentando, para que a solução aquosa de açúcar ferva.
Lembre-se do seguinte fato: quanto maior a massa molar de uma substância, maior será seu ponto de ebulição e menor seu ponto de solidificação.
A ebulição ocorre quando o vapor que se encontra dentro das bolhas formadas no fundo do recipiente adquire uma pressão igual ou maior que a pressão atmosférica. Assim, com a presença das partículas do soluto, a massa molar aumenta, sendo necessário que a solução seja aquecida até que sua pressão de vapor se iguale à atmosférica.

Com a adição de açúcar na água, ela para de ferver
3. Crioscopia ou Criometria: é o estudo da diminuição da temperatura de solidificação (ou de fusão, pois são processos inversos que possuem o mesmo valor) de um solvente pela adição de um soluto não volátil.
Em países muito frios, a neve presente nas estradas é descongelada com maior facilidade usando-se sal. Em países tropicais, usa-se esse mesmo princípio para congelar cervejas mais rapidamente, colocando-as no gelo com sal misturado. Nesses casos, o gelo derrete, porém a sua temperatura aumenta. Por que isso ocorre?
Conforme dito no item anterior, com a adição do soluto, a massa molar aumenta, assim será necessário que se esfrie mais, ou seja, que se diminua ainda mais a temperatura para que o líquido congele.

O gelo é mais facilmente derretido com o uso do sal
4. Osmose: é o fluxo do solvente de uma solução menos concentrada para uma mais concentrada ou menos diluída, por meio de uma membrana semipermeável. Isso significa que há um aumento da pressão osmótica do solvente em direção à solução mais concentrada.
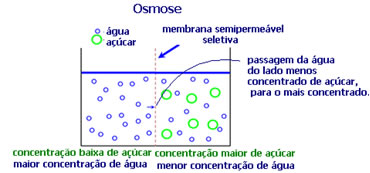
Por exemplo, se colocarmos uma folha de alface em uma panela com água, a folha irá ficar mais hidratada. Já se colocarmos sal, ela irá murchar. Isso ocorre por causa da osmose. No primeiro caso, o meio menos concentrado é a água, que passará então para dentro da folha, hidratando-a. E, na segunda situação, o meio menos concentrado é dentro da folha, então a sua água passará para o lado de fora que está mais concentrado e menos diluído e ela irá murchar.

Videoaulas relacionadas: