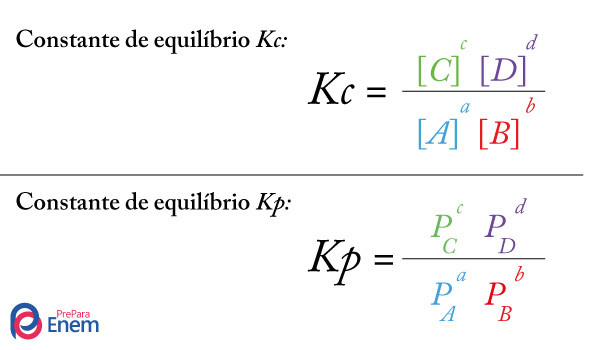O Princípio de Le Chatelier diz o seguinte:
“Quando um equilíbrio é alterado por um fator externo, ocorre um deslocamento no sentido que anula a alteração”.
A ação de catalizadores não provoca o deslocamento desse equilíbrio. Os fatores que fazem isto são: a variação da concentração, da pressão e da temperatura. Aqui analisaremos apenas um deles: a concentração.
Variação da concentração em um sistema em equilíbrio:
Se aumentarmos a concentração dos reagentes de uma reação em equilíbrio químico, a taxa de desenvolvimento (Td) da reação direta irá aumentar, pois o sistema irá deslocar o equilíbrio para a reação direta, procurando aumentar a quantidade de produtos.
Por exemplo, considere a reação em equilíbrio entre gás hidrogênio e gás carbônico (dióxido de carbono).
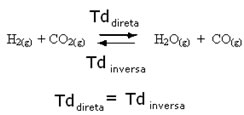
Se acrescentarmos a esta reação mais gás hidrogênio (H2) ou mais dióxido de carbono (CO2), a reação se deslocará no sentido direto para produzir mais água (H2O) e monóxido de carbono (CO).
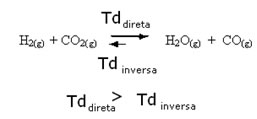
O contrário também é verdadeiro, se adicionarmos mais monóxido de carbono ou água, a reação se deslocará no sentido inverso, para a formação de mais reagentes.
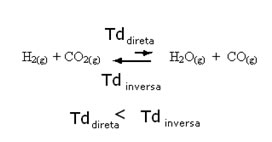
Falamos de acrescentar reagentes ou produtos, mas e se os retirarmos?
O mesmo ocorre, mas agora o equilíbrio será deslocado no sentido que possui menos substância.
Quando a reação se encontra no equilíbrio químico original, microscopicamente, em nível atômico-molecular, a atividade é grande, mas não é possível ver mudança nenhuma a olho nu.
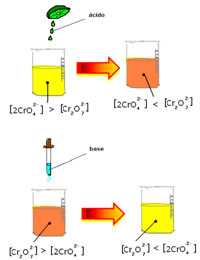
Todavia, ao se deslocar o equilíbrio em virtude da variação da concentração, nota-se que em alguns casos ocorre a mudança da coloração da solução e é possível visualizar seu deslocamento. Um exemplo é a reação demonstrada abaixo:
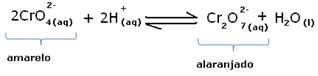
Se adicionarmos alguma solução ácida ou mais reagente 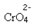 , a concentração de íons H+ aumentará na solução, deslocando o equilíbrio para a direita, fazendo com que a solução assuma uma coloração alaranjada. Como já havia o íon H+ no meio, denomina-se esse fato de efeito do íon comum.
, a concentração de íons H+ aumentará na solução, deslocando o equilíbrio para a direita, fazendo com que a solução assuma uma coloração alaranjada. Como já havia o íon H+ no meio, denomina-se esse fato de efeito do íon comum.
Já se acrescentarmos uma base, como o hidróxido de sódio (NaOH) ou um pouco mais do produto 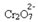 , o equilíbrio será deslocado para a esquerda (reação inversa) e a cor mudará para amarelo, conforme a figura abaixo indica.
, o equilíbrio será deslocado para a esquerda (reação inversa) e a cor mudará para amarelo, conforme a figura abaixo indica.