As primeiras pilhas inventadas usavam recipientes contendo soluções aquosas como eletrodos. Por exemplo, a Pilha de Daniell era formada por uma lâmina de zinco mergulhada numa solução de sulfato de zinco (ZnSO4) e em outro recipiente separado, uma lâmina de cobre numa solução de sulfato de cobre (CuSO4).
Assim, quando uma nova pilha que não usava soluções aquosas foi inventada em 1866, pelo químico francês George Leclanché (1839-1882), ela passou a ser chamada de pilha seca ou pilha seca de Leclanché.

George Leclanché (1839-1882)
Na realidade, porém, esse tipo de pilha não é seca, porque ela contém uma pasta úmida em seu interior, como será explicado mais adiante.
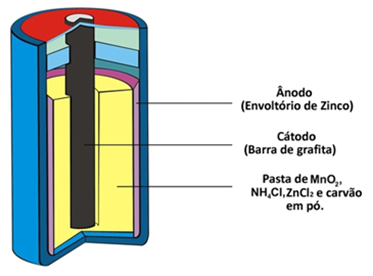
Ela também é chamada de pilha de zinco-carbono, pois um de seus eletrodos, o ânodo (polo negativo), é formado por um cilindro ou envoltório de zinco metálico que fica separado das outras substâncias químicas por meio de um papel poroso. Já o eletrodo positivo (cátodo) é uma barra central de grafita (carbono).
Essa pilha ainda é chamada de pilha de zinco-dióxido de manganês porque a barra de grafita é coberta por uma camada de dióxido de manganês (MnO2), além de carvão em pó e uma pasta úmida formada por cloreto de amônio (NH4C?) e cloreto de zinco (ZnC?2). Os cloretos mencionados são sais de caráter ácido e, por isso, a pilha de Leclanché recebe um último nome: pilha comum ácida.
De forma simplificada, as reações que ocorrem nessa pilha e que permitem o seu funcionamento podem ser descritas da seguinte forma:
Ânodo: O zinco metálico é oxidado, perdendo elétrons:
Polo Negativo – Ânodo: Zn (s) → Zn2+ (aq) + 2 e-
Cátodo: O manganês presente na pasta interna recebe os elétrons e se reduz. Esses elétrons são conduzidos pela barra de grafita:
Polo positivo – 2 MnO2(aq) + 2 NH4 1+ (aq) + 2e- → 1 Mn2O3 (s) + 2NH3(g) + 1 H2O(l)
Reação global:
Zn (s) + 2 MnO2(aq) + 2 NH4 1+ (aq) → Zn2+ (aq) + 1 Mn2O3 (s) + 2NH3(g)
A ponte salina é a pasta úmida.
Observe que quando o manganês se reduz, o dióxido de manganês se transforma em trióxido de manganês. Por isso, quando todo o dióxido de manganês é convertido, a reação para e a pilha cessa o seu funcionamento, não sendo possível recarregá-la e usá-la novamente.
Além disso, observe que a reação que ocorre no cátodo produz amônia (NH3). Essa substância se envolve na barra de grafita impedindo o fluxo dos elétrons e diminuindo o “tempo de vida” da pilha. Porém, isso pode ser revertido se deixarmos a pilha em repouso fora do equipamento. Uma baixa temperatura ajuda ainda mais; veja como isso ocorre lendo o texto: Pilha seca volta a funcionar quando colocada na geladeira?
A pilha seca de Leclanché possui uma voltagem de 1,5 V e é indicada para equipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos.

Aproveite para conferir nossa videoaula sobre o assunto:












