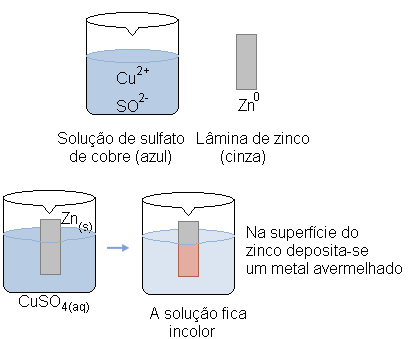
Observe a ilustração acima e imagine que mergulhamos em um recipiente contendo solução aquosa de sulfato de cobre (CuSO4), que é de coloração azul, uma lâmina de zinco (Zn). Com o passar do tempo, notaríamos que a cor cinza da lâmina de zinco seria substituída por uma cor vermelho-amarelada, somente na parte que ficou em contato com a solução. Além disso, a solução, antes azul, estaria incolor.
Como podemos explicar esse fato?
Podemos identificar a camada vermelho-amarelada formada na lâmina de zinco, como sendo cobre metálico (Cu0), já a solução perdeu sua cor azul porque os íons Cu2+ foram substituídos pelos íons Zn2+.
Este é um exemplo de reação de oxidorredução.

Exemplo: Foi o que ocorreu com o zinco:
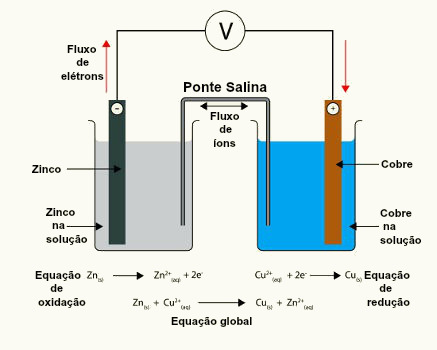
Zn0 → Zn2+ + 2 elétrons

Exemplo: No exemplo acima, o cobre sofreu redução.
Cu2+ + 2 elétrons → Cu0
Quando representamos a reação global, ou seja, a soma das duas semirreações, os elétrons são cancelados:
Zn0 → Zn2+ + 2 elétrons
Cu2+ + 2 elétrons → Cu0
Zn0 + Cu2+ → Zn2+ + Cu0
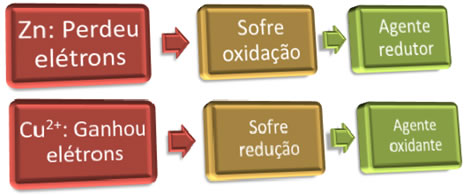
Para que a oxidação ocorra, “alguém” tem que ganhar os elétrons; e o contrário também é verdadeiro, para que a redução ocorra, “alguém” tem que doar os elétrons. Assim, temos o agente redutor e o agente oxidante, que são:

Exemplo: O zinco sofreu oxidação, portanto, ele é o agente redutor, pois foi ele que cedeu elétrons para o cobre reduzir.

Exemplo: O cobre sofreu redução, assim, ele é o agente oxidante, pois ele recebeu os elétrons do zinco, causando a sua oxidação.
Para a reação considerada temos: