A tabela periódica apresenta diversos elementos químicos (118, no total), mas apenas sete deles são considerados estáveis, os chamados gases nobres. Esses gases são chamados assim porque não necessitam ligar-se a nenhum outro elemento, sendo encontrados na natureza de forma isolada. A estabilidade de um átomo muitas vezes está relacionada com a teoria do octeto, que enuncia que, para ser estável, o elemento deve apresentar:
-
Oito elétrons na camada de valência (como o neônio, argônio, xenônio, criptônio e radônio);
-
Dois elétrons na camada de valência (como o hélio).
Como a maioria dos outros elementos da tabela não é estável, eles devem então estabelecer ligações químicas entre si para atingir a estabilidade. Essas ligações podem acontecer de três formas: iônica (quando um átomo perde seus elétrons na camada de valência e outro recebe esses elétrons), metálica (ligação que envolve átomos de um mesmo elemento que tem a tendência de perder elétrons) e molecular. Para que a ligação molecular ocorra, os átomos, além de apresentarem tendência de receber elétrons, devem ser:
-
dois ametais diferentes;
-
dois ametais iguais;
-
um ametal e um hidrogênio;
-
dois hidrogênios.
Além disso, os elétrons devem estar presentes (de forma isolada) em orbitais semipreenchidos de ambos os átomos, como descrito a seguir:
Átomo 1 de Hidrogênio Átomo 2 de Hidrogênio


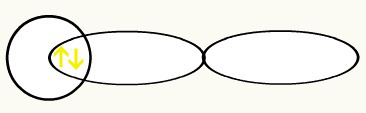
A ocorrência da ligação molecular envolve a interpenetração de dois orbitais atômicos incompletos. A união desses dois orbitais dá origem a um único orbital, o chamado orbital molecular. Esse orbital formado apresenta então dois elétrons com spins contrários, caracterizando uma estrutura estável. Acompanhe a formação de orbitais moleculares de algumas moléculas para ilustrar a teoria proposta:
1º exemplo: H2
O hidrogênio apresenta número atômico igual a 1, assim sua distribuição eletrônica é:
1s1
Como o subnível (s) tem apenas um orbital, este está semipreenchido:

Orbital do subnível (s) preenchido com um elétron
Os hidrogênios são representados pela forma do orbital (s), que é uma esfera:
H H
1s1 1s1


Com a união desses dois orbitais, teremos a formação do orbital molecular com dois elétrons do H2:
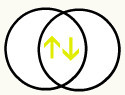
2º Exemplo: F2
O flúor apresenta número atômico 9 e tem a seguinte distribuição eletrônica:
1s2
2s2 2p5
Os dois orbitais (s) estão completos por apresentarem dois elétrons. Já o subnível (p), que comporta no máximo seis elétrons, está incompleto, pois apresenta apenas cinco elétrons. A distribuição dos elétrons nos orbitais do subnível (p) é feita segundo a regra de Hund (primeiro acrescentamos um elétron em cada orbital com spins no mesmo sentido e, depois, voltamos ao primeiro orbital e colocamos mais um elétron com spins contrários):
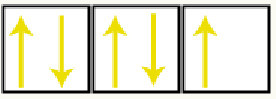
Três orbitais do subnível preenchidos com cinco elétrons
Observamos que um orbital p está semipreenchido. Assim, cada átomo do flúor será representado por meio da forma de um orbital p:
F F
1s2 1s2
2s2 2p5 2s2 2p5
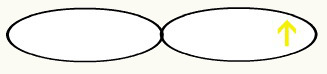
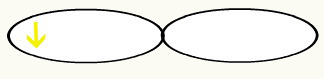
Com a união dos dois orbitais incompletos de flúor, teremos a formação do orbital molecular com dois elétrons:
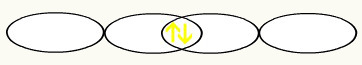
3º Exemplo: HF
Como temos um hidrogênio e um flúor e cada um deles já foi exposto nos exemplos anteriores, aqui o orbital s do H interpenetrará o orbital p do F, que está incompleto, formando um orbital molecular com dois elétrons:
H F
1s1 1s2
2s2 2p5


Com a união dos dois orbitais incompletos de hidrogênio e flúor, teremos a formação do orbital molecular: