O nitrogênio é um elemento químico de número atômico (Z) 7, massa molar 14,0067 g/mol e pontos de fusão e ebulição respectivamente iguais a -209,9 ºC e - 195,8 ºC. Esse elemento é o mais abundante no ar atmosférico, compondo cerca de 78% de seu volume em massa. Cerca de 20% do ar é constituído de gás oxigênio e 1% de outros gases, tais como argônio, gás carbônico e vapor de água.
As moléculas de gás nitrogênio presentes no ar são formadas cada uma por dois átomos de nitrogênio unidos por uma ligação tripla, uma ligação química muito forte, na qual se compartilham três pares de elétrons (N2 → N ≡ N).
.jpg)
Apesar de estar presente em grande quantidade na atmosfera, o teor de nitrogênio na crosta terrestre é relativamente escasso, na ordem de 19 ppm, o que significa que em cada tonelada há 19 g dele. Ele é o 33º elemento em ordem de abundância.
O gás nitrogênio não é muito reativo nem inflamável, por isso ele é empregado em processos químicos quando se deseja uma atmosfera inerte e também já foi muito usado no preenchimento de bulbos de lâmpadas de filamento para reduzir o processo de vaporização deste. Mas, atualmente, ele tem sido substituído pelo argônio, que é mais inerte. O gás nitrogênio é vendido em cilindros de aço para ser usado como gás inerte na produção de produtos eletrônicos, no empacotamento de alimentos e para encher pneus.
Quando se calibra os pneus com gás nitrogênio, é preciso pagar por isso, pois ele é mais vantajoso do que calibrar os pneus com ar. O oxigênio do ar comprimido não é inerte como o nitrogênio e pode oxidar alguns materiais. Além disso, a variação da pressão do nitrogênio em relação à temperatura é bem menor que a do ar comprimido.
.jpg)
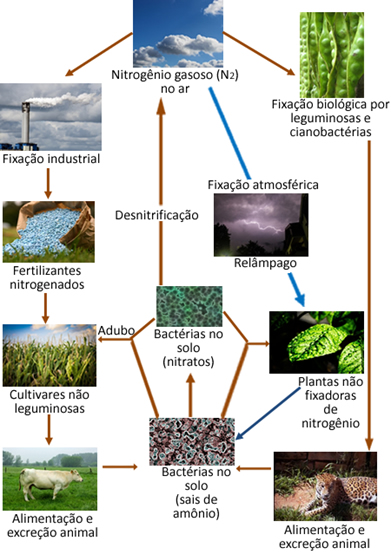
Entretanto, apesar de ser inerte, o nitrogênio deve ser forçado a reagir, pois ele é um elemento essencial para a vida, já que ele é componente das proteínas e do DNA de todos os seres vivos do planeta. A principal fonte de nitrogênio para as plantas e animais está no N2 da atmosfera. Toda forma de transformação do N2 da atmosfera em outros compostos de nitrogênio é denominada de fixação de nitrogênio.
Por exemplo, certas plantas, como o feijão, e os organismos marinhos, como as algas, e um grande número de bactérias possuem enzimas que são capazes de induzir o gás nitrogênio do ar a reagir, “fixando-se” na forma de amônia (NH3) ou íons amônio (NH4+) por meio de redução. Esse processo de redução catalisada por enzimas feito pelas bactérias, que é conhecido como fixação biológica de nitrogênio, representa 90% de toda a fixação de origem natural.
O gás nitrogênio da atmosfera pode reagir com o gás oxigênio do ar formando óxidos de nitrogênio (NOX), principalmente o NO2. Mas essa reação envolve uma grande quantidade de energia, por isso ela acontece na atmosfera por meio de descargas de relâmpagos. Por meio das tempestades, esses compostos e outros que contêm nitrogênio descem para a terra e são absorvidos pelas raízes das plantas.
Abaixo temos uma ilustração do ciclo do nitrogênio, que é um dos ciclos mais importantes e complexos, pois envolve um intercâmbio de nitrogênio entre a atmosfera, a matéria orgânica e compostos inorgânicos.
Os óxidos de nitrogênio mencionados podem reagir com a água da chuva, dando origem aos ácidos nitroso e nítrico, ou seja, originam uma espécie de chuva ácida que apesar de não ser considerada nociva, em longo prazo, pode causar certo impacto ambiental.
NO2(g) + H2O(l)→ HNO2(aq) + HNO3(aq)
Conforme já dito, o nitrogênio é um constituinte do ácido nítrico e dos nitratos, por isso ele recebeu esse nome, que vem do grego, genio, formador de; e nitron, de nitratos, isto é, “formador de nitratos”. Esse nome foi dado por Jean-Antoine-Claude Chaptal em 1790. Lavoisier preferia chamá-lo de azoto, que é uma palavra que vem do grego azoti, que quer dizer “não vida”, visto que ele não mantinha a vida.
Daniel Rutherford é considerado o descobridor do nitrogênio, que o anunciou em sua tese de doutorado em 12 de setembro de 1772. Rutherford o chamava de ar nocivo, porque não servia para manter a vida.

O nitrogênio líquido é usado como refrigerante, tanto para o congelamento de produtos alimentícios como para o transporte de alimento, também é usado como meio de resfriamento no transporte de órgãos para transplante e na conservação de sêmen para inseminação artificial do gado, já que garante uma temperatura de 190º C abaixo de zero. Similarmente, um de seus compostos, a amônia, é o mais comum dos gases refrigerantes, usado principalmente na produção de gelo e na manutenção de baixas temperaturas na indústria.

A produção industrial do gás nitrogênio é feita retirando-o do ar por meio de destilação fracionada (processo de Linde). Isso é feito submetendo o ar a sucessivas compressões e resfriamentos até que ele chegue ao estado líquido.