O átomo é um sistema eletricamente neutro; o que significa que ele apresenta a mesma quantidade de prótons (partículas positivas) e de elétrons (partículas negativas). No entanto, o átomo, ou um grupo de átomo ligado, tem a capacidade de perder ou ganhar elétrons. Quando isso ocorre, dizemos que ele formou um íon. Assim, podemos conceituá-lo da seguinte maneira:
Íon é o átomo, ou grupos de átomos, que tem número de prótons diferente do número de elétrons.
Cátions: é a denominação para o íon quando ele perde um ou mais elétrons (partículas negativas) e, consequentemente, fica com carga positiva.
Exemplo:
.jpg)
Átomo de sódio inicialmente neutro. Após perder um elétron, torna-se um íon, o cátion sódio
Ânions: é a denominação para o íon quando ele recebe um ou mais elétrons, ficando, portanto, carregado negativamente.
Exemplo:
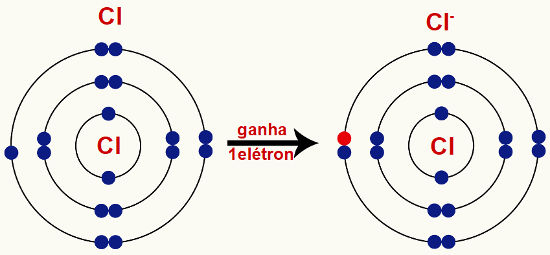
Átomo de cloro neutro. Depois de ganhar um elétron, torna-se um íon, o cátion cloreto
Os casos citados são exemplos de íons simples, formados por apenas um elemento. Outros exemplos são: K+, Ag+, Ca2+, Al3+, Pb4+, F-, O2-, N3-, C4-, etc.
Entretanto, quando os íons são formados por grupos de átomos de elementos químicos que ganharam ou perderam elétrons, diz-se que são íons compostos.
Exemplos de cátions compostos:NH4+, H3O+
Exemplos de ânions compostos: SO42-, P2O74-
Aproveite para conferir as nossas videoaulas sobre o assunto: