A teoria mais aceita e usada atualmente que prevê de maneira mais simples a geometria de cada molécula é o modelo da repulsão de pares de elétrons na camada de valência (RPECV) ou VSEPR (do inglês, valence shell eléctron repulsion). Este modelo, relativamente preciso, foi desenvolvido pelo cientista inglês Ronald James Gillespie, partindo do modelo de ligação covalente.
Segundo esse modelo, os pares de elétrons da camada de valência de um átomo devem se distanciar o máximo possível um dos outros. Há uma força de repulsão entre eles.
Cada par eletrônico costuma ser representado por uma nuvem eletrônica ovalada, conforme a figura abaixo, que fica ao redor do átomo central. Essa nuvem pode corresponder também a:

O modo como essas nuvens ficam distantes umas das outras, organizando-se no espaço, pode ser entendida quando fazemos uma analogia com balões, conforme a figura abaixo:

A 1ª situação é igual à geometria linear; a 2ª, à geometria angular e a 3ª, à geometria tetrédrica.
Assim, baseando nessa teoria, temos as seguintes geometrias moleculares possíveis:
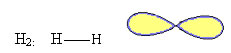
1. Molécula com dois átomos: como não possui um átomo central, será geometria linear.
Exemplo:
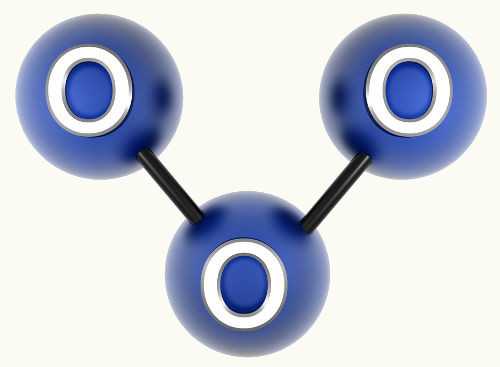
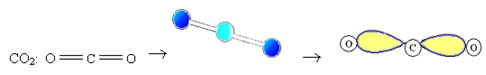
2. Molécula com três átomos: Pode ser geometria linear ou angular.
2.1.Linear: Quando o átomo central não possui par de elétrons emparelhados disponíveis.
Exemplo:
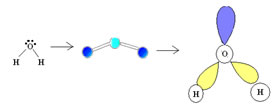
2.2. Angular: Quando o átomo central possui par de elétrons emparelhados disponíveis.
Exemplo: H2O
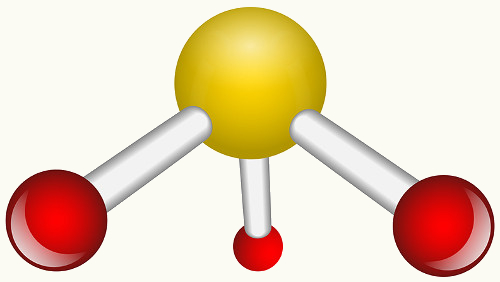
3. Molécula com quatro átomos:
3.1 Trigonal plana ou triangular: Quando o átomo central não possui par de elétrons emparelhados disponíveis.
Exemplo: SO3
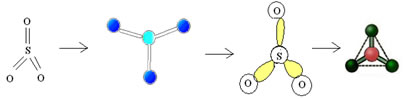
3.2. Piramidal ou pirâmide trigonal: Quando o átomo central possui par de elétrons emparelhados disponíveis.
Exemplo: NH3
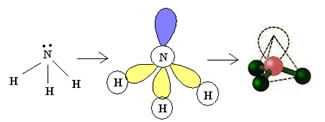
4. Molécula com cinco átomos:
4.1- Tetraédrica com ângulo de 109°28’: Quando o átomo central não possui par de elétrons emparelhados disponíveis.
Exemplo: CH4
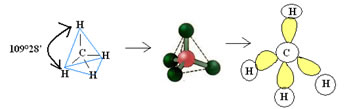
4.2. Quadrado Planar: Quando o átomo central não possui par de elétrons emparelhados disponíveis. Exemplo: ICl4
5. Molécula com seis átomos:
5.1. Bipirâmide trigonal ou Bipirâmide triangular.
Exemplo: PCl5
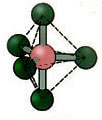
5.2. Pirâmide Quadrada: Exemplo: IF5
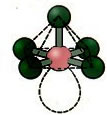
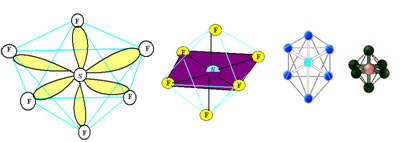
6. Molécula com sete átomos: Octaédrica.
Exemplo: SF6