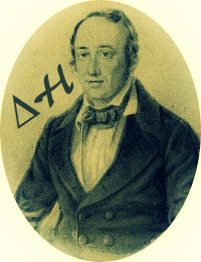Nas reações estudadas na Termoquímica há liberação (exotérmicas) ou absorção (endotérmicas) de calor.
Por exemplo, quando se acampa, normalmente se constrói uma fogueira, para que o calor liberado e a luz emitida pela queima da madeira possam aquecer e iluminar o ambiente. Essa reação de combustão da madeira é uma reação exotérmica, pois libera calor.
Porém, surge a questão: “De onde veio essa energia em forma de calor?”.
Essa energia já estava presente nas moléculas que, no estado gasoso, apresentam movimento caótico, desordenado, que gera pressão. Assim, a energia liberada já estava contida nos reagentes e, ao se produzirem os produtos, essa energia é liberada. Para se entender como cada substância já apresenta um conteúdo de energia, pense, por exemplo, na energia envolvida nos movimentos dos átomos e das moléculas e na energia associada à atração e à repulsão entre as partículas, como íons, moléculas ou prótons e elétrons.

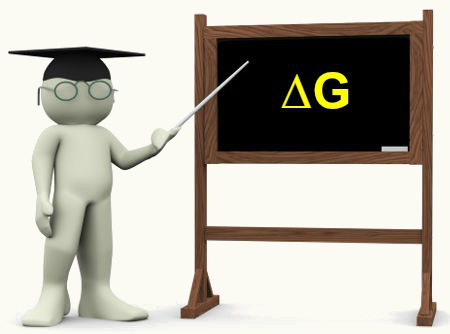
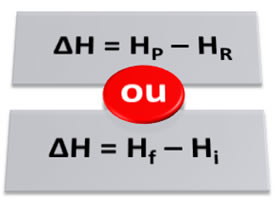
A entalpia varia de acordo com a constituição das substâncias. Entretanto, é impossível calcular a entalpia que cada substância apresenta. Assim, costuma-se calcular não a entalpia, mas a variação de entalpia (?H) do processo. Isso é feito através da diferença entre a entalpia dos produtos (entalpia final) e a entalpia dos reagentes (entalpia inicial):
Lembrando que a variação de entalpia é sempre calculada em sistemas que apresentam troca de calor sob pressão constante.
Se o valor da variação de entalpia der negativo, significa que o sistema perdeu energia na forma de calor, ou seja, é um processo exotérmico. O contrário também é verdadeiro: se a variação da entalpia der positiva, maior que zero, a reação é endotérmica, pois significa que se ganhou ou absorveu calor.
Além disso, visto que a variação da entalpia depende de uma série de fatores (temperatura, pressão, estado físico e número de mol), criou-se um referencial para que se compare a entalpia da substância, que foi denominada entalpia padrão (H0).

Quando todos os reagentes e produtos de uma reação estão no seu estado padrão, a variação de entalpia será denominada variação de entalpia padrão (?H0).
Videoaulas relacionadas: