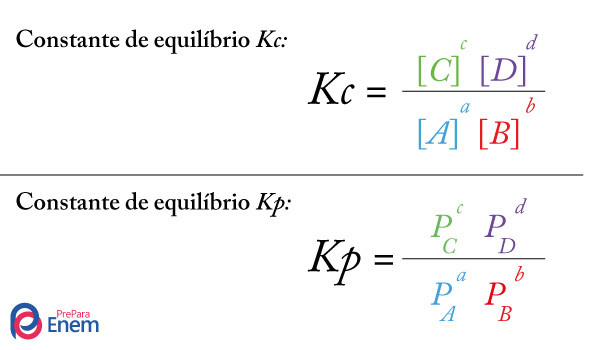As constantes de equilíbrio químico Kc e Kp são constantes fundamentais no estudo das reações químicas e da termodinâmica. Kc refere-se à constante de equilíbrio em termos de concentrações molares, enquanto Kp é a constante de equilíbrio em termos de pressões parciais de gases. Sendo assim, essas constantes indicam a posição do equilíbrio de uma reação química e como as concentrações ou pressões dos reagentes e produtos influenciam esse equilíbrio.
Leia também: Afinal, o que é equilíbrio químico?
Tópicos deste artigo
- 1 - Resumo sobre constantes de equilíbrio químico Kc e Kp
- 2 - Videoaula sobre as constantes de equilíbrio Kc e Kp
- 3 - O que são as constantes de equilíbrio Kc e Kp?
- 4 - Qual é a fórmula do Kc?
- 5 - Como calcular o Kc?
- 6 - Qual é a fórmula do Kp?
- 7 - Como calcular o Kp?
- 8 - Relação entre o Kc e o Kp
- 9 - Quais são as diferenças entre Kc e Kp?
- 10 - Exercícios resolvidos sobre constantes de equilíbrio químico Kc e Kp
Resumo sobre constantes de equilíbrio químico Kc e Kp
- As constantes de equilíbrio químico Kc e Kp são constantes fundamentais no estudo das reações químicas e da termodinâmica.
- Kc é a constante de equilíbrio em concentração, usada para reações em solução aquosa.
- Kp é a constante de equilíbrio em pressão, usada para reações que envolvem gases.
- Kc relaciona as concentrações dos produtos e reagentes em equilíbrio, enquanto Kp relaciona as pressões parciais dos gases em equilíbrio.
- As unidades de medida para Kc são molar (M) ou mol/L, e para Kp são atmosfera (atm) ou Pascal (Pa).
- As fórmulas para Kc e Kp dependem dos coeficientes estequiométricos da reação balanceada.
- A fórmula para calcular Kc é:
\(K_c = \frac{{[C]}^{c} {[D]}^{d}}{{[A]}^{a} {[B]}^{b}} \)
- A fórmula para calcular Kp é:
\(K_p = \frac{{P_{\text{C}}^{c} P_{\text{D}}^{d}}}{{P_{\text{A}}^{a} P_{\text{B}}^{b}}} \)
- Ambas as constantes variam com a temperatura, de acordo com a equação ΔG = −RTln(K).
- Existe uma relação matemática entre Kc e Kp para reações que envolvem gases, dada por Kp= Kc(RT)Δn, onde Δn é a variação do número de mols de gases.
Videoaula sobre as constantes de equilíbrio Kc e Kp
O que são as constantes de equilíbrio Kc e Kp?
As constantes de equilíbrio Kc e Kp são constantes usadas para expressar o equilíbrio químico em reações químicas em solução aquosa (Kc) ou em gases (Kp). É importante destacar que as constantes de equilíbrio, no geral, são valores que descrevem a relação de equilíbrio existente entre as concentrações dos reagentes e dos produtos em uma reação química.
Qual é a fórmula do Kc?
A fórmula do Kc segue o padrão geral de equilíbrio químico, sendo: a razão do produto das concentrações dos produtos da reação pelo produto das concentrações dos reagentes, com todas as concentrações elevadas aos respectivos coeficientes estequiométricos. Para entendermos melhor, vejamos como isso se aplica em uma reação genérica:
aA+bB ⇌ cC+dD
Diante disso, a constante de equilíbrio, Kc, é definida pela seguinte expressão:
\(K_c = \frac{{[C]}^{c} {[D]}^{d}}{{[A]}^{a} {[B]}^{b}} \)
Em que [A], [B], [C], [D] são as concentrações dos reagentes e produtos em equilíbrio, e a, b, c, d são os coeficientes estequiométricos da reação balanceada.
Como calcular o Kc?
Para calcular Kc, você precisa conhecer as concentrações em equilíbrio dos produtos e dos reagentes, bem como os coeficientes estequiométricos da reação balanceada. Diante disso, vejamos o passo a passo desse cálculo:
- Escreva a equação química balanceada.
- Determine as concentrações de equilíbrio.
- Substitua as concentrações na fórmula do Kc.
- Calcule o valor de Kc.
Exemplo:
Para a reação de formação de 0,5 mol de amônia temos a seguinte equação não balanceada, em que há 0,2 mol de N2 reagindo com 0,6 mol de H2 em um recipiente de 1 litro.
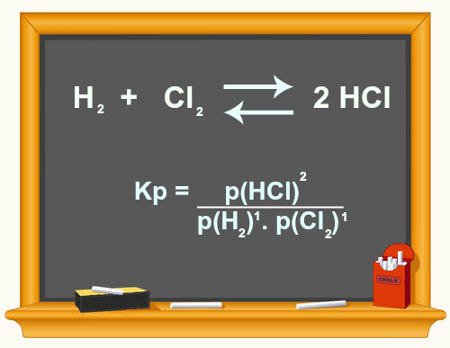
N2(g) + H2(g) ⇌ NH3(g)
Qual é o valor do Kc?
Resolução:
-
Escreva a equação química balanceada:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
-
Determine as concentrações de equilíbrio:
N2 = 0,2 mol/L
H2 = 0,6 mol/L
NH3 = 0,5 mol/L
-
Substitua as concentrações na fórmula do Kc:
\(K_c = \frac{{[{\text{NH}}_3]}^{2}}{{[{\text{N}}_2]} [{\text{H}}_2]^{3}} \)
\(K_c = \frac{{[0,5]}^{2}}{{[0,2]} [0,6]^{3}} \)
-
Calcule o valor de Kc:
\(K_c = \frac{0,25}{0.04 \times 0,216} \) → \(K_c = \frac{0,25}{0,00864} \) → \(Kc = 28,93\)
Sendo assim, a constante de equilíbrio para a reação em análise é Kc = 28,93.
Veja também: Como fazer o balanceamento de reações químicas?
Qual é a fórmula do Kp?
A fórmula do Kp também segue o padrão geral de equilíbrio químico, sendo: a razão do produto das concentrações dos produtos da reação pelo produto das concentrações dos reagentes, com todas as concentrações elevadas aos respectivos coeficientes estequiométricos.
\(K_p = \frac{{P_{\text{C}}^c P_{\text{D}}^d}}{{P_{\text{A}}^a P_{\text{B}}^b}} \)
Em que PA, PB, PC, PD são as pressões parciais dos gases envolvidos na reação.
Como calcular o Kp?
Para calcular o valor da constante de equilíbrio Kp, você precisa conhecer as pressões parciais dos gases em equilíbrio, bem como os coeficientes estequiométricos da reação balanceada. Uma vez obtendo essas informações, o passo a passo desse cálculo é o seguinte:
- Escreva a equação química balanceada.
- Determine as pressões parciais.
- Substitua as pressões parciais na fórmula do Kp.
- Calcule o valor de Kp.
A diferença em relação ao cálculo do Kc é que ao invés das concentrações (mol/L), aqui aplicamos as pressões parciais.
Exemplo 1:
Considere novamente a reação de formação da amônia, mas use os valores das pressões parciais de cada gás envolvido:
N2(g) + H2(g) ⇌ NH3(g)
PN2 = 1,0 at,
PH2 = 2,0 atm
PNH3 = 3,0 atm
Qual é o valor de Kp?
Resolução:
-
Escreva a equação química balanceada:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
-
Determine as pressões parciais:
PN2 = 1,0 atm
PH2 = 2,0 atm
PNH3 = 3,0 atm
-
Substitua as pressões parciais na fórmula do Kp:
\(K_p = \frac{{P_{\text{NH}_3}^2}}{{P_{\text{N}_2} \cdot P_{\text{H}_2}^3}} \) → \(K_p = \frac{(3{,}0)^2}{(1{,}0) \cdot (2{,}0)^3} \)
-
Calcule o valor de Kp
\(K_p = \frac{9{,}0}{1{,}0 \cdot 8{,}0} \)= 1,125
Logo, o valor de Kp para essa reação é 1,125.
Exemplo 2:
Considere a reação de decomposição do pentacloreto de fósforo (PCl5) em equilíbrio com o tricloreto de fósforo (PCl3) e cloro (Cl2):
PCl5(g) ⇌ PCl3(g) + Cl2(g)
Suponha que, em um experimento, as pressões parciais em equilíbrio sejam as seguintes:
PCl5 = 2,0atm
PCl3 = 1,5atm
PCl2 = 1,0atm
Qual é o valor de Kp?
Resolução:
-
Escreva a equação química balanceada:
PCl5(g) ⇌ PCl3(g) + Cl2(g)
-
Determine as pressões parciais:
PCl5 = 2,0atm
PCl3 = 1,5atm
PCl2 = 1,0atm
-
Substitua as pressões na fórmula do Kp e 4. Calcule o valor de Kp:
Neste caso, a equação já está balanceada. Além disso, todos os coeficientes estequiométricos são iguais a 1, não sendo necessário sinalizá-los como expoente. Sendo assim, basta seguir com os demais passos:
\(K_p = \frac{1{,}5 \times 1{,}0}{2{,}0} \) → \(Kp = 0,75\)
Para saber mais detalhes sobre como calcular a constante de equilíbrio Kp, clique aqui.
Relação entre o Kc e o Kp
A relação entre Kc e Kp está na variação do número de mols de gases da reação e pode ser obtida a partir da seguinte expressão:
Kp = Kc(RT)Δn
- Kp → constante de equilíbrio em pressão parcial
- Kc → constante de equilíbrio em concentração
- R → constante dos gases ideais (0,0821 atm⋅L/mol⋅K)
- T → temperatura em Kelvin
- Δn → variação do número de mols de gases entre os produtos e os reagentes Δn = (c+d) − (a+b)
Exemplo:
Considere a seguinte reação:
N2O4(g) ⇌ 2NO2(g)
Suponha que Kc = 1,8×10−5 a uma temperatura de 1000 K. Sendo assim, calcule Kp para essa reação.
Resolução:
-
Passo 1: Calcular Δn.
Δn = 2 − 1 → Δn = 1
-
Passo 2: Substituir os valores na fórmula.
Kp = 1,8×10−5 × (0,0821 x 1000)1
-
Passo 3: Calcular Kp.
Kp = 1,8×10−5 × 82,1 → Kp = 1,5×10−3
Logo, Kp para essa reação é aproximadamente Kp = 1,5×10−3.
Portanto, essa relação indica como as constantes de equilíbrio estão relacionadas e como podem ser convertidas uma na outra para uma reação que envolva gases. Sendo assim, isso permite que se determine a constante de equilíbrio em pressão a partir da constante de equilíbrio em concentração, e vice-versa, facilitando os cálculos em diferentes condições de uma reação química.
Quais são as diferenças entre Kc e Kp?
Sabemos que as constantes de equilíbrio Kc e Kp são usadas para descrever o equilíbrio de uma reação química, mas existem diferenças importantes entre elas, principalmente relacionadas aos estados físicos dos reagentes e produtos. Sendo assim, destacamos no quadro abaixo as principais diferenças entre Kc e Kp:
|
Característica |
Kc |
Kp |
|
Definição |
Relaciona as concentrações dos produtos e reagentes em equilíbrio em solução aquosa. |
Relaciona as pressões parciais dos gases em equilíbrio em reações gasosas. |
|
Unidade de medida |
Molar (M) ou mol/L |
Atmosfera (atm) ou Pascal (Pa) |
|
Fórmula |
\(K_c = \frac{{[C]}^c {[D]}^d}{{[A]}^a {[B]}^b} \) |
\(K_p = \frac{{P_{\text{C}}^c P_{\text{D}}^d}}{{P_{\text{A}}^a P_{\text{B}}^b}} \) |
Essas diferenças são importantes para compreender como as reações químicas são afetadas por mudanças nas condições de temperatura, pressão e concentração. Diante disso, vale ressaltar que em ambos os casos, essas constantes são afetadas pela temperatura.
Acesse também: O que é o deslocamento de equilíbrio químico?
Exercícios resolvidos sobre constantes de equilíbrio químico Kc e Kp
Questão 1
(Uerj) Considere a reação de equilíbrio químico representada abaixo, que ocorre na atmosfera e envolve dois óxidos de nitrogênio:
N2O4 (g) ⇌ 2 NO2 (g)
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
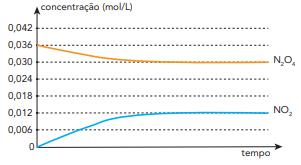
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
A) 3,2 x 10-3
B) 4,8 x 10-3
C) 3,3 x 10-1
D) 4,0 x 10-1
Resolução:
Alternativa B.
Primeiro, vamos identificar as concentrações de cada componente no equilíbrio:
N2O4 = 0,03; NO2 = 0,012
Agora, aplicamos na expressão:
\(K_c = \frac{(0,012)^2}{0,03} \) = 4,8 x 10-3
Questão 2
(UFRGS) A combustão incompleta de substâncias contendo carbono pode formar o monóxido de carbono, o qual é extremamente tóxico. O monóxido de carbono, na presença de oxigênio, pode ser convertido no dióxido de carbono, em catalisadores automotivos, de acordo com a reação abaixo.
2 CO (g) + O2 (g) ⇋ 2 CO2 (g)
Em um determinado recipiente, contendo inicialmente monóxido de carbono e oxigênio, estabeleceu-se um equilíbrio em que se pode determinar a pressão total da mistura, 6,1 atm, e as pressões parciais de monóxido de carbono e de dióxido de carbono, as quais foram, respectivamente, 0,5 atm e 4,0 atm.
O valor da constante de equilíbrio será igual a
A) 1,6
B) 10,6
C) 22,4
D) 32
E) 40
Resolução:
Alternativa E.
Perceba que foram dados os valores das pressões parciais dos gases envolvidos na reação. Logo, trata-se do cálculo de Kp. Após verificar que a equação da reação está balanceada, monta-se a expressão do Kp e, em seguida, a substituição dos valores. Mas antes, vamos descobrir a pressão parcial do oxigênio. Para isso, basta subtrair da pressão total a soma dos outros gases: PO2 = 6,1 – (0,5 + 4,0) = 1,6. Sendo assim, temos:
\(K_p = \frac{P_{\text{CO}_2}^2}{P_{\text{O}_2} \cdot P_{\text{CO}}^2} \) → \(K_p = \frac{(4{,}0)^2}{(1{,}6) \cdot (0{,}5)^2} \) → \(K_p = 40\)
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. O equilíbrio químico. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 397–423.
L. BROWN, T. et al. Constantes de equilíbrio. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 664–669.
QUILEZ, J. Acerca de los Orígenes de la Ley de Equilibrio Químico. Journal Anales de Química, v. 113, n. 3, p. 191–197, 2017.