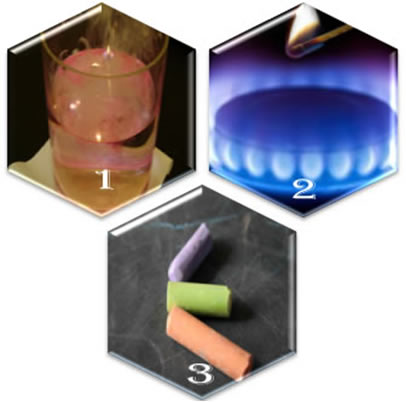
Imagine três situações diferentes:
(1ª) Ao colocarmos sódio metálico na água, a reação ocorre violentamente, de forma rápida;
(2ª) Ao abrirmos a válvula de um fogareiro, o gás irá escapar, porém a reação só ocorrerá se colocarmos um palito de fósforo aceso no queimador;
(3ª) Ao deixar um giz em contato com o ar, não acontecerá nada, nem mesmo se aproximarmos dele um palito de fósforo aceso.
O que essas três situações nos mostram? Que algumas reações ocorrem espontaneamente, como no primeiro caso. Já para que outras ocorram é necessário o fornecimento de energia, como no segundo exemplo. E, por fim, na terceira situação, vimos que nem todos os fenômenos resultam em reação química.
Assim, existem algumas condições necessárias para a ocorrência das reações, entre elas as principais são: natureza dos reagentes, contato entre eles e energia de ativação.
- Natureza dos Reagentes ou “Afinidade Química” → No dia a dia observa-se que algumas substâncias possuem diferentes afinidades químicas umas com as outras, ou seja, a natureza dos reagentes define se há a possibilidade de reagirem entre si.
Como no caso do giz não existe afinidade química entre seus componentes e o ar, eles não reagem. Já o sódio é muito reativo tanto com a água como com o ar, assim ele precisa ser guardado em querosene, para não reagir com o oxigênio presente no ar.
- Contato entre os Reagentes → Ácidos e bases reagem, pois eles possuem a afinidade citada no item anterior. Porém, se estiverem em frascos separados, não irão reagir. É fundamental que as espécies reagentes sejam colocadas em contato para que as partículas que formam seus aglomerados possam colidir umas com as outras, rompendo as ligações que existem e formando novas ligações (e, consequentemente, novas substâncias).
- Energia de Ativação e Teoria da Colisão → Toda reação só ocorre se no sistema tiver uma energia mínima necessária, que varia de reagente para reagente. Essa energia é denominada energia de ativação.
No primeiro exemplo, a reação ocorre espontaneamente porque o próprio sistema já contém a energia de ativação necessária. No segundo caso, é necessário fornecer energia aos reagentes para que eles atinjam a energia de ativação. Isso é feito por meio da chama do palito de fósforo.
A Teoria das Colisões explica por que algumas substâncias têm afinidade química e outras não; e também como se obtém a energia de ativação para dar início à reação. Essa teoria explica que quando as moléculas dos reagentes colidem, para que seja uma colisão efetiva que rompa suas ligações e forme novas, tem que se dar com duas condições muito importantes: a energia envolvida na colisão tem que ser maior que a energia de ativação e deve ser uma colisão com orientação adequada. Se isso não ocorrer, a reação também não ocorrerá.