O texto Ligação Covalente, Molecular ou Homopolar mostrou que as ligações covalentes são realizadas por átomos que têm a tendência de ganhar elétrons para ficarem estáveis, sendo que eles compartilham pares de elétrons entre si. Quando ocorre somente esse tipo de ligação entre um número limitado e determinado de átomos, formam-se as moléculas ou compostos moleculares.
Alguns exemplos de moléculas são:
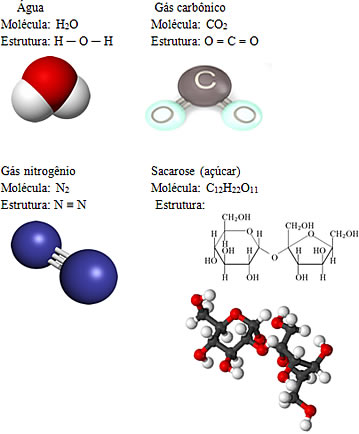
Como os exemplos acima mostram, os compostos moleculares podem se encontrar nos três estados físicos em temperatura ambiente (sólidos como o açúcar, líquidos como a água e gasosos como o gás carbônico e o nitrogênio). No entanto, visto que esses compostos se atraem menos intensamente que os compostos iônicos, a maioria deles encontra-se como gases e líquidos de ponto de ebulição baixo.
Em comparação às substâncias iônicas, os pontos de fusão e ebulição dos compostos covalentes são bem menores, porque já que a atração entre suas moléculas é menos intensa, é necessário menos energia para separá-las e fazê-las mudar de estado físico.
Quando comparamos os compostos moleculares entre si, observamos que o tipo de força intermolecular interfere nas temperaturas de fusão e ebulição, que aumentam com a seguinte ordem:
Ligações de hidrogênio > dipolo permanente > dipolo induzido
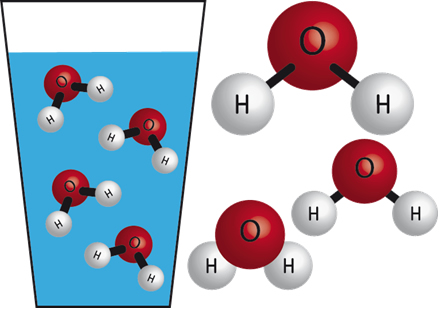
Por exemplo, a água realiza o tipo de força intermolecular mais intensa, isto é, ligações de hidrogênio, sendo que seu ponto de ebulição ao nível do mar é de 100 ºC. Já o cloro (C?2) realiza interações do tipo dipolo induzido, tendo um ponto de ebulição bem menor, que é igual a -33,97 ºC.
Agora, se compararmos dois compostos que realizam o mesmo tipo de força intermolecular, o que tiver maior massa molar terá os maiores pontos de fusão e de ebulição. Por exemplo, o propano (C3H8) também realiza interações do tipo dipolo induzido, mas sua massa molar (44 g/mol) é menor que a do cloro (71 g/mol), por isso o seu ponto de ebulição também é menor (-42 ºC).
Mas também pode acontecer dos átomos de determinados elementos se ligarem por meio do compartilhamento de elétrons e não formarem moléculas, mas sim macromoléculas, que possuem uma quantidade muito grande de átomos, geralmente um número indeterminado. Esses são os compostos covalentes ou de rede covalente.
Alguns exemplos são:
.jpg)
Todos eles são sólidos em condições normais de temperatura e pressão, e como suas massas molares representam valores muito altos, os seus pontos de fusão e ebulição são também bastante elevados. Para citar um exemplo, o ponto de ebulição do diamante é de 4 826, 85 ºC, sendo nessa temperatura em que ele sublima.
Tanto os compostos covalentes quanto os moleculares não conduzem corrente elétrica, com exceção da grafita, que conduz bem eletricidade no estado sólido. Isso acontece em virtude de sua estrutura, que forma anéis hexagonais que possuem duplas ligações, ou ligações pi (π), conjugadas, que permitem a migração dos elétrons. Além disso, os carbonos assumem uma hibridização sp2 (plana), formando folhas superpostas como "colmeias", isto é, que estão paralelas; e ligações em planos diferentes, que são mais fracas, permitindo a movimentação de elétrons entre os planos, ou seja, ocorre a transferência da eletricidade.