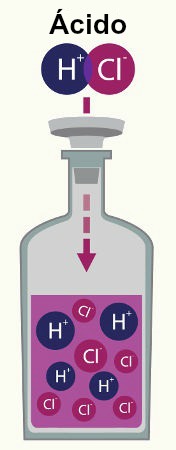
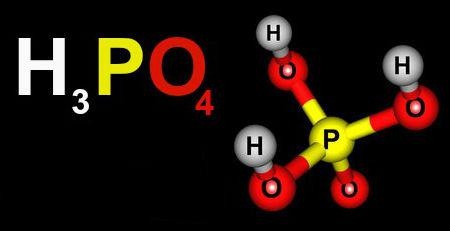
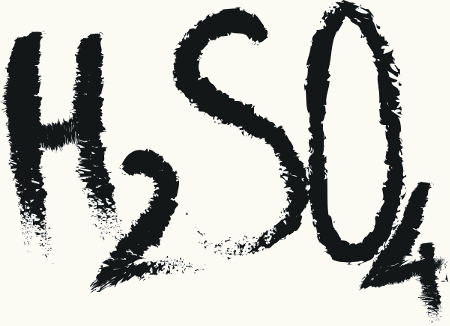Ácido é toda substância que se ioniza em presença de água e origina íons H+.
Como podemos classificar os ácidos? De acordo com vários critérios, vejamos alguns:
Classificação quanto ao número de hidrogênios ionizáveis:
Dependendo da quantidade de íons H+ liberados por molécula ionizada, os ácidos se classificam em:
Monoácidos: liberam um íon H+ por molécula.
Diácidos: dois íons H+ são liberados por molécula.
Triácidos: liberam três íons H+ por cada molécula.
Tetrácidos: até quatro íons H+ por molécula.
Classificação quanto à força ácida:
O meio ácido é caracterizado pela presença de íons H+ que são gerados pela ionização. A facilidade com que os ácidos se ionizam em água e outros solventes é medida pela força do ácido, sendo que, ácidos fortes liberam H+ com maior facilidade. Veja os exemplos:
Ácidos fortes: HI (ácido iodídrico), HBr (ácido bromídrico) e HCl (ácido clorídrico).
Ácido semiforte: HF (ácido fluorídrico).
Ácido fraco: HCN (ácido cianídrico).
Aproveite para conferir nossa videoaula sobre o assunto: