Vimos no texto “Exceções à Regra do Octeto” que vários compostos são formados sem seguir a regra do octeto. Mas, então, podem surgir dúvidas sobre como representar os arranjos entre os átomos na formação de uma molécula.
Por exemplo, digamos que queremos escrever a fórmula eletrônica de Lewis e a fórmula estrutural plana do monóxido de dinitrogênio (N2O). Esse composto é também conhecido como óxido nitroso e é popular no meio automobilístico como NOS (Nitrous Oxide Sistem). Ele costuma ser usado para aumentar a potência do motor dos carros.
Considere duas possibilidades de estruturas para esse composto:

Qual das duas estruturas está correta?
Para responder a essa pergunta precisamos calcular a carga formal de cada um dos átomos presentes nas moléculas. A estrutura correta será aquela cuja carga formal dos átomos está mais próxima de zero.
A carga formal é calculada através da fórmula:
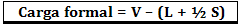
Onde:
V = número de elétrons de valência livre do átomo;
L = número de elétrons presentes nos pares isolados;
S = número de elétrons compartilhados.
Exemplo:
Vamos calcular a carga formal para as duas possibilidades:

Observe que os valores que se aproximam mais de zero é o da primeira possibilidade. Assim, concluímos que o monóxido de dinitrogênio possui a estrutura 1 e não a 2.


