O método por tentativa e erro visto no texto “Balanceamento de Equações” é muito eficaz para muitas equações de reações químicas. No entanto, quando se trata de reações por oxidorredução, fica muito difícil usar esse método para balanceá-las.
Por isso, existe outro meio de fazer isso, lembrando que o objetivo do balanceamento por oxirredução é acertar os coeficientes das espécies químicas e com isso igualar a quantidade de elétrons doados e recebidos.
Para entender como realizar o balanceamento das equações das reações por oxidorredução, veja o exemplo a seguir.
O permanganato de potássio (KMnO4) reage com o peróxido de hidrogênio – água oxigenada ─ (H2O2) em meio ácido. A solução de permanganato é violeta, mas, com o tempo, observa-se que ocorre uma descoloração da solução, que libera gás oxigênio. Essa reação pode ser representada pela seguinte equação:
KMnO4 + H2SO4 +H2O2 → K2SO4 +H2O +O2 +MnSO4
Observe que, por exemplo, há apenas um átomo de potássio (K) no primeiro membro (reagentes), mas existem dois átomos de potássio no 2º membro (produtos). Isso mostra que essa reação não está balanceada. Para balanceá-la precisamos seguir as seguintes etapas:
(1º) Análise dos números de oxidação (Nox) de cada elemento:
Para saber determinar o número de oxidação dos elementos nas espécies químicas reagentes e nos produtos, leia o texto “Determinação do Número de Oxidação (Nox)”. Com base nas regras dadas nesse artigo, chegamos aos seguintes Nox para os elementos na reação em questão:

Observe que por meio dos Nox podemos determinar quem sofreu redução ou oxidação. Nesse caso, o átomo de manganês do permanganato perdeu dois elétrons (∆Nox = 7 – 2 = 5), sofrendo, então, redução e atuando como o agente oxidante do oxigênio. O oxigênio do peróxido recebeu dois elétrons do manganês; portanto, ele sofreu oxidação (∆Nox = 0 – (-1) = 1) e agiu como um agente redutor.
(2º) Escolha das espécies químicas em que se deve iniciar o balanceamento:
Começamos o balanceamento pelas espécies que participaram do ganho e da perda de elétrons, que no caso podem ser o permanganato e o peróxido no 1º membro, ou o oxigênio e o sulfato de manganês no 2º membro.
Normalmente o balanceamento é feito nas espécies químicas do 1º membro (reagentes). No entanto, como regra geral, temos os seguintes critérios:
- Possui prioridade o membro que tiver maior número de átomos que sofrem oxirredução;
- Se o critério acima não for observado, escolhemos o membro com maior número de espécies químicas.
Nessa equação, o 2º membro possui mais espécies químicas, por isso vamos começar o balanceamento com o O2 e com o MnSO4.
(3º) Determinar o número de elétrons recebidos e doados (multiplicar o índice pelo ∆Nox):
- Vimos que o ∆Nox do oxigênio foi igual a 1, o que significa que ele recebeu 1 elétron. Porém, são dois átomos de oxigênio, então serão 2 elétrons recebidos:
O2 = ∆Nox = 2 . 1 = 2
- No caso do manganês há apenas um átomo dele na espécie química, então serão 5 elétrons doados:
MnSO4= ∆Nox = 1 . 5 = 5
(4º) Igualar os números de elétrons recebidos e doados (inverter os ∆Nox pelos coeficientes):
Para igualar os coeficientes da equação, deve-se ter certeza que a mesma quantidade de elétrons doador pelo peróxido tenha sido recebida pelo permanganato. Para isso basta inverter os ∆Nox das espécies químicas escolhidas pelos seus coeficientes:
O2 = ∆Nox = 2 → 2 será o coeficiente de MnSO4
MnSO4 = ∆Nox = 5→ 5 será o coeficiente de O2
KMnO4 + H2SO4 +H2O2 → K2SO4 +H2O + 5O2+ 2 MnSO4
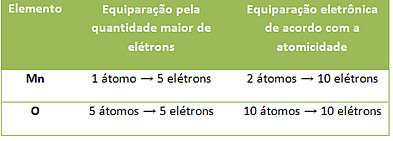
Note que dessa forma ficam exatamente 10 elétrons recebidos e doados, conforme explicado na tabela abaixo:
(5º) Continuar balanceamento pelo método de tentativa e erro:
Agora que já sabemos que existem 2 átomos de manganês no 2º membro, esse também será o coeficiente da espécie que possui esse átomo no 1º membro:
2 KMnO4 + H2SO4 +H2O2 → K2SO4 +H2O + 5O2+ 2 MnSO4
Veja que com isso acabamos balanceando também o potássio no 1º membro, que ficou tendo dois átomos desse elemento. Visto que no 2º membro já possui 2 átomos de potássio, então seu coeficiente será 1:
2 KMnO4 + H2SO4 +H2O2 → 1 K2SO4 +H2O +5 O2+2 MnSO4
Agora também sabemos que a quantidade de átomos de enxofre (S) no 2º membro é igual a 3 (1 + 2), consequentemente o coeficiente que colocaremos no ácido sulfúrico é 3:
2 KMnO4 + 3 H2SO4 +H2O2 → 1 K2SO4 +H2O +5 O2+2 MnSO4
Atenção: reações de oxirredução normais poderiam ser terminadas até o final somente com os passos seguidos aqui. No entanto, essa reação envolve água oxigenada (H2O2), sendo um caso especial de reação de oxirredução. Nesses casos, deve-se levar em conta se ela está agindo como agente oxidante ou redutor. Aqui ela é redutora, o que é caracterizado pela produção de O2 e, como todo O2 é proveniente da água oxigenada, as duas substâncias apresentam o mesmo coeficiente. Em razão desse fato, o coeficiente da água oxigenada nessa reação será 5:
2 KMnO4 + 3H2SO4 +5 H2O2 → 1 K2SO4 +H2O +5 O2+2 MnSO4
Dessa forma, todo o primeiro membro está balanceado, tendo no total 16 átomos de H (3 . 2 + 5 . 2 = 16). Assim, o coeficiente da água no 2º membro será 8, que multiplicado pelo índice do H, que é 2, dá 16:
2 KMnO4 + 3H2SO4 +5H2O2 → 1 K2SO4 + 8 H2O +5 O2+2 MnSO4
Pronto, o balanceamento terminou. Mas para verificar se ele está realmente correto falta confirmar se a quantidade de átomos de oxigênio está igual nos dois membros. Veja que tanto no 1º membro (2 . 4 + 3 . 4 + 5 . 2 = 30) quanto no 2º membro ( 1 . 4 + 8 + 5 . 2 + 2 . 4 = 30) deu igual a 30.