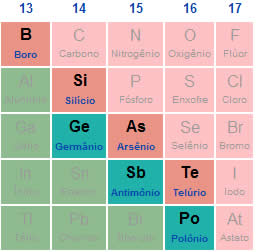
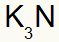Os compostos iônicos são aqueles que apresentam em sua constituição um elemento metálico acompanhado de um ametal ou um hidrogênio. Por essa razão, temos a chamada ligação iônica entre esses átomos, em que um átomo ganha elétrons e o outro perde. A quantidade de elétrons recebida ou perdida está relacionada com a natureza do átomo e a quantidade de elétrons na camada de valência. Veja a tabela a seguir:
|
Família |
Natureza |
Camada de valência |
Tendência |
|
1A |
Metais |
1 elétron |
Perder um elétron |
|
2A |
Metais |
2 elétrons |
Perder dois elétrons |
|
3A |
Há metais e um ametal |
3 elétrons |
Perder três elétrons, se metal, e ganhar três elétrons, se ametal |
|
4A |
Há metais e ametais |
4 elétrons |
Perder quatro elétrons, se metal, e ganhar quatro elétrons, se ametal |
|
5A |
Há metais e ametais |
5 elétrons |
Perder cinco elétrons, se metal, e ganhar três elétrons, se ametal |
|
6A |
Há metais e ametais |
6 elétrons |
Ganhar dois elétrons, se ametal, e perder seis elétrons, se metal |
|
7A |
Ametais |
7 elétrons |
Ganhar um elétron |
Todo composto originado por uma ligação iônica apresenta uma fórmula que o representa, que é chamada de íon-fórmula ou fórmula mínima. Ela representa a quantidade mínima de cada um dos átomos necessários para a formação do retículo cristalino da substância iônica formada.
Para montar o íon-fórmula, basta conhecer as cargas adotadas pelos átomos envolvidos e seguir a regra proposta abaixo:
- carga do metal transforma-se na quantidade do ametal ou hidrogênio
- carga do ametal ou hidrogênio transforma-se na quantidade do metal
Acompanhe alguns exemplos de montagem de íons-fórmulas:
1º) Entre Magnésio e Cloro:
|
Mg Família 2A |
Cl Família 7A |
Logo:
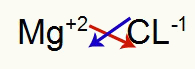
O que resulta em:
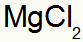
2º) Entre Alumínio e Enxofre:
|
Al Família 3A |
S Família 6A |
Logo:
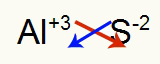
O que resulta em:
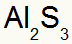
3º) Entre Potássio e Nitrogênio:
|
K Família 1A |
N Família 5A |
Logo:
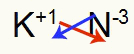
O que resulta em: